sábado, 1 de junio de 2013
viernes, 24 de mayo de 2013
LOS HIDRÓXIDOS
Los hidróxidos se forman por reacción de los óxidos básicos con el agua. Tienen la siguiente fórmula general:
Me (OH)x siendo x igual al número de oxidación del metal. Es por eso que la regla práctica indica escribir el metal seguido de tantos OH (oxhidrilos) como el número de oxidación.
Si se plantea la reacción:
Na2O + H2O -------------- Na2O2H2 simplificando y balanceando : 2 NaOH
CaO + H2O ---------------- CaO2H2 o Ca(OH)2
Si el metal tiene número de oxidación 3, el óxido reacciona con 3 moléculas de agua y se tiene:
Al2O3 + 3 H2O --------------- Al2 O6 H6 simplificando y balanceando: 2 Al (OH)3
Si tiene número de oxidación 4, el óxido reacciona con 2 moléculas de agua y se tiene:
PtO2 + 2 H2O ------------- Pt (OH)4
Nomenclatura
Antigua: utiliza los sufijos oso e ico. Se nombran como el óxido del que provienen reemplazando la palabra óxido por hidróxido.
Ejemplos:
Hidróxido ferroso
Hidróxido férrico
Numerales de Stock: se nombran con la palabra hidróxido indicando entre paréntesis y en números romanos el número de oxidación del metal.
Ejemplos:
Hidróxido de hierro (II)
Hidróxido de hierro (III)
Sistemática:
Dihidróxido de hierro Fe (OH)2
Trihidróxido de hierro Fe(OH)3
Utilidad De Los Hidróxidos En La Industria
Utilidad De Los Hidróxidos En La Industria
Utilidad industrial de los hidróxidos:
-Las bases son utilizadas para fabricar productos de limpieza
-Las bases son utilizadas para anular los efectos de ácidos cuando se produce algún inconveniente en su uso, manejo, etc.
-Algunas bases se usan incluso para producir explosivos (NaOH) recordemos que el sodio es explosivo al contacto con el agua
-Volviendo a mencionar su facultad de anular ácidos se utilizan en la fabricación de medicamentos (antiacidos)
-Las bases son utilizadas para fabricar productos de limpieza
-Las bases son utilizadas para anular los efectos de ácidos cuando se produce algún inconveniente en su uso, manejo, etc.
-Algunas bases se usan incluso para producir explosivos (NaOH) recordemos que el sodio es explosivo al contacto con el agua
-Volviendo a mencionar su facultad de anular ácidos se utilizan en la fabricación de medicamentos (antiacidos)
-------------------------------------------------
-El hidróxido sódico (NaOH) se emplea mucho en la industria de los jabones y los productos de belleza y cuidado corporal. Su principal uso es en la soponificacion de determinados ácidos grasos para formar jabón También interviene en la fabricación de tejidos o papel, y se utiliza como base química y detergente.
El hidróxido potásico tiene similares aplicaciones.
Ambos compuestos se emplean también en los productos de limpieza o en los desinfectantes.
El hidróxido de calcio tiene un papel importante como intermediario en importantisimos procesos industriales como el proceso Solvay por el cual se obtiene industrial mente el carbonato sódico.
El hidroxido de aluminio mineral, la gibosita, es una importante parte del mineral bauxita, a partir del cual se obtiene industrial mente el aluminio.
Estos son algunos ejemplos, hay mas pero ahora mismo son los que te puedo decir a botepronto, los mas importantes.
-------------------------------------------------
• El hidróxido de calcio entre otros han sido usados por mucho tiempo en la odontología debido a sus propiedades anti bacterianas y a su favorable biocompatibilidad cuando se compara con otros agentes anti bacteriales. También usado en la construcción. Forma parte del cemento que se procesa en grandes fábricas como Cruz Azul o Cemex.
-El hidróxido sódico (NaOH) se emplea mucho en la industria de los jabones y los productos de belleza y cuidado corporal. Su principal uso es en la soponificacion de determinados ácidos grasos para formar jabón También interviene en la fabricación de tejidos o papel, y se utiliza como base química y detergente.
El hidróxido potásico tiene similares aplicaciones.
Ambos compuestos se emplean también en los productos de limpieza o en los desinfectantes.
El hidróxido de calcio tiene un papel importante como intermediario en importantisimos procesos industriales como el proceso Solvay por el cual se obtiene industrial mente el carbonato sódico.
El hidroxido de aluminio mineral, la gibosita, es una importante parte del mineral bauxita, a partir del cual se obtiene industrial mente el aluminio.
Estos son algunos ejemplos, hay mas pero ahora mismo son los que te puedo decir a botepronto, los mas importantes.
-------------------------------------------------
• El hidróxido de calcio entre otros han sido usados por mucho tiempo en la odontología debido a sus propiedades anti bacterianas y a su favorable biocompatibilidad cuando se compara con otros agentes anti bacteriales. También usado en la construcción. Forma parte del cemento que se procesa en grandes fábricas como Cruz Azul o Cemex.
Hidróxidos: para aplicación en la industria papelera
La empresa Ciaries ofrece hidróxido para su aplicación en la industria del papel.
En la industria papelera, se utilizan óxido e hidróxido. El óxido en el proceso de obtención de pasta de papel se encarga de regenerar la sosa cáustica que utilizan para aumentar la eficiencia, y sirve también como agente blanqueante en los procesos posteriores. El hidróxido también se utiliza como agente blanqueante y como reactivo de floculación y neutralizante a la depuración de aguas de proceso.
En la industria papelera, se utilizan óxido e hidróxido. El óxido en el proceso de obtención de pasta de papel se encarga de regenerar la sosa cáustica que utilizan para aumentar la eficiencia, y sirve también como agente blanqueante en los procesos posteriores. El hidróxido también se utiliza como agente blanqueante y como reactivo de floculación y neutralizante a la depuración de aguas de proceso.
Bibliografía:
http://jeniferpaolaballesterosmartinez.blogspot.com/2013/05/utilidad-de-los-hidroxidos-en-la.html
http://www.interempresas.net/Laboratorios/FeriaVirtual/Producto-Hidroxidos-98012.html
http://jeniferpaolaballesterosmartinez.blogspot.com/2013/05/utilidad-de-los-hidroxidos-en-la.html
http://www.interempresas.net/Laboratorios/FeriaVirtual/Producto-Hidroxidos-98012.html
viernes, 12 de abril de 2013
Fuerzas intermoleculares
Las fuerzas intermoleculares se definen como el conjunto de fuerzas atractivas y repulsivas que se producen entre las moléculas como consecuencia de la polaridad que poseen las moléculas.
Cuando dos o más átomos se unen mediante un enlace químico forman una molécula, los electrones que conforman la nueva molécula recorren y se concentran en la zona del átomo con mayor electronegatividad, definimos la electronegatividad como la propiedad que tienen los átomos en atraer electrones. La concentración de los electrones en una zona definida de la molécula crea una carga negativa, mientras que la ausencia de los electrones crea una carga positiva.
Denominamos dipolos a las moléculas que disponen de zonas cargadas negativamente y positivamente debido a la electronegatividad y concentración de los electrones en las moléculas.
Podemos asimilar el funcionamiento de un dipolo a un imán con su polo positivo y su polo negativo, de tal forma que si acercamos otro imán el polo positivo atraerá al polo negativo y viceversa, dando como resultado una unión.
Las fuerzas intermoleculares que actúan entre las moléculas se clasifican en :
- Dipolos permanentes
- Dipolos inducidos
- Dipolos dispersos.
- Puentes de hidrógeno
Dentro de los 4 grupos descritos anteriormente, las fuerzas más relevantes son las 3 primeras, también conocidas como fuerzas de Van der Waals.
Dipolos permanentes
Este tipo de unión se produce cuando ambas moléculas disponen de cargas positivas y negativas, es decir son moléculas que polares o que tienen polaridad, atrayéndose electrostaticamente y formando la unión.
Dipolos inducidos
Este tipo de unión se produce cuando una molécula no polar redistribuye la concentración de los electrones (tiene la posibilidad de polarizarse) al acercarse una molécula polar, de tal forma que se crea una unión entre ambas moléculas.
En este caso la molécula polar induce la creación de la molécula apolar en una molécula polar.
Dipolos dispersos
Este último caso la unión se produce entre moléculas no polares pero que pueden polarizarse, y cuando esto último ocurren se atraen mutuamente creando la unión molecular.
La unión que se crea en este tipo de dipolos tiene una intensidad muy débil y una vida muy corta
Las energías de unión generadas por las fuerzas intermoleculares son más reducidas que las energías generadas en los enlaces químicos, pero existen en mayor número que los otros, por lo que a nivel global implican un papel muy importante.
Van der Waals ------ 0,1 a 10 Kj/mol
Enlace Covalente ------ 250 – 400 Kj/mol.
Enlace Covalente ------ 250 – 400 Kj/mol.
Fuerzas dipolo dipolo
Las moléculas polares neutras se atraen cuando el extremo positivo de una de ellas está cerca del extremo negativo de otra.
 En los líquidos, las moléculas polares están en libertad de moverse unas respecto a otras, a veces están en orientaciones que son atractivas y a veces en orientaciones repulsivas. Dos moléculas que se atraen pasan más tiempo cerca una de otra que dos que se repelen, por lo que el efecto global es una atracción neta. Si examinamos diversos líquidos, observaremos que para moléculas con masas y tamaños aproximadamente iguales, la intensidad de las atracciones intermoleculares aumenta al incrementarse la polaridad para que operen fuerzas dipolo-dipolo, las moléculas deben poder juntarse en la orientación correcta. Por tanto, en el caso de moléculas con polaridad parecida, las que tienen menor volumen molecular generalmente experimentan fuerzas de atracción dipolo-dipolo más intensas.
En los líquidos, las moléculas polares están en libertad de moverse unas respecto a otras, a veces están en orientaciones que son atractivas y a veces en orientaciones repulsivas. Dos moléculas que se atraen pasan más tiempo cerca una de otra que dos que se repelen, por lo que el efecto global es una atracción neta. Si examinamos diversos líquidos, observaremos que para moléculas con masas y tamaños aproximadamente iguales, la intensidad de las atracciones intermoleculares aumenta al incrementarse la polaridad para que operen fuerzas dipolo-dipolo, las moléculas deben poder juntarse en la orientación correcta. Por tanto, en el caso de moléculas con polaridad parecida, las que tienen menor volumen molecular generalmente experimentan fuerzas de atracción dipolo-dipolo más intensas.Enlace por puente de hidrógeno
El enlace de por puente de hidrógeno en realidad no es un enlace propiamente dicho, sino que es la atracción experimentada por un átomo electronegativo y un átomo de hidrógeno que están formando parte de distintos enlaces covalentes polares.
El átomo con mayor electronegatividad atraerá hacia si los electrones del enlace, formándose un dipolo negativo, mientras que el átomo de hidrógeno, al ceder parcialmente sus electrones, genera un dipolo de carga positiva en su entorno. Estas cargas opuestas se atraen.
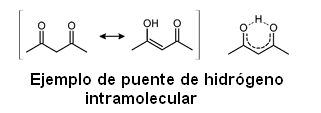
El puente de hidrógeno es un caso especial de la interacción dipolo-dipolo. El enlace por puente de hidrógeno puede ser intermolecular (en el caso del agua por ejemplo) o puede darse también dentro de una misma molécula, siendo denominado en este caso puente de hidrógeno intramolecular.
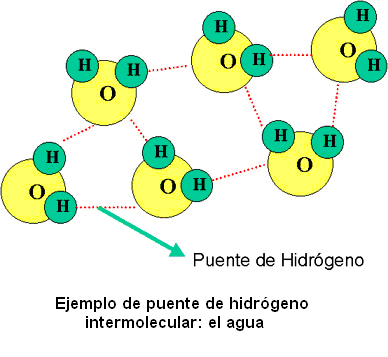
Además, cada molécula de agua puede estar unida con cuatro moléculas más, mediante puentes de hidrógeno, ya que cada oxígeno puede formar, mediante su par libre de electrones, dos puentes de hidrógeno, y además, los dos átomos de hidrógeno de la molécula forman dos puentes más. Esta multitud de enlaces por puente de hidrógeno es lo que brinda cualidades especiales al agua.
Los enlaces de hidrógeno intramoleculares intervienen en la formación de las estructuras secundarias, terciarias y cuaternarias de las proteínas y en la estabilidad de los ácidos nucleicos. En éstos últimos, los puentes de hidrógeno son los que unen los pares de bases de las dos cadenas de ADN, formando la doble hélice.
La fuerza del puente de hidrógeno es por lo general entre diez y veinte veces menor que la de un enlace covalente promedio. Aún así, este tipo de enlace comparte algunas características con el enlace covalente, por ejemplo, provoca distancias interatómicas menores que la suma de los radios de Van der Waals.
Los átomos que más frecuentemente se encuentran formando puentes de hidrógeno son el nitrógeno, oxígeno, flúor, cloro, entre otros. A continuación se detallan algunos valores de la fuerza de puentes de hidrógeno:
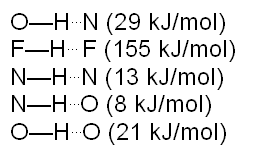
n subtipo de enlace de hidrógeno es el puente de hidrógeno simétrico, en el cual el átomo de hidrógeno se encuentra equidistante del átomo al cual está unido covalentemente y del átomo con el cual está formando el enlace. Es un enlace mucho más fuerte que los puentes de hidrógeno comunes, con orden de enlace 0.5. Se ha observado este tipo de puente en hielo a altas presiones.
Bibliografía:
Bibliografía:
Lee todo en: Enlace por puente de hidrógeno | La Guía de Química http://quimica.laguia2000.com/conceptos-basicos/enlace-por-puente-de-hidrogeno#ixzz2QJb8DYxF
Suscribirse a:
Entradas (Atom)


